Un neurone per volta: dall’Università di Pisa un metodo all’avanguardia per investigare le strutture fondamentali del nostro cervello
La ricerca, pubblicata su Nature Communications, introduce un metodo innovativo che permette di vedere la forma di un singolo neurone isolandolo dalle connessioni del tessuto cerebrale
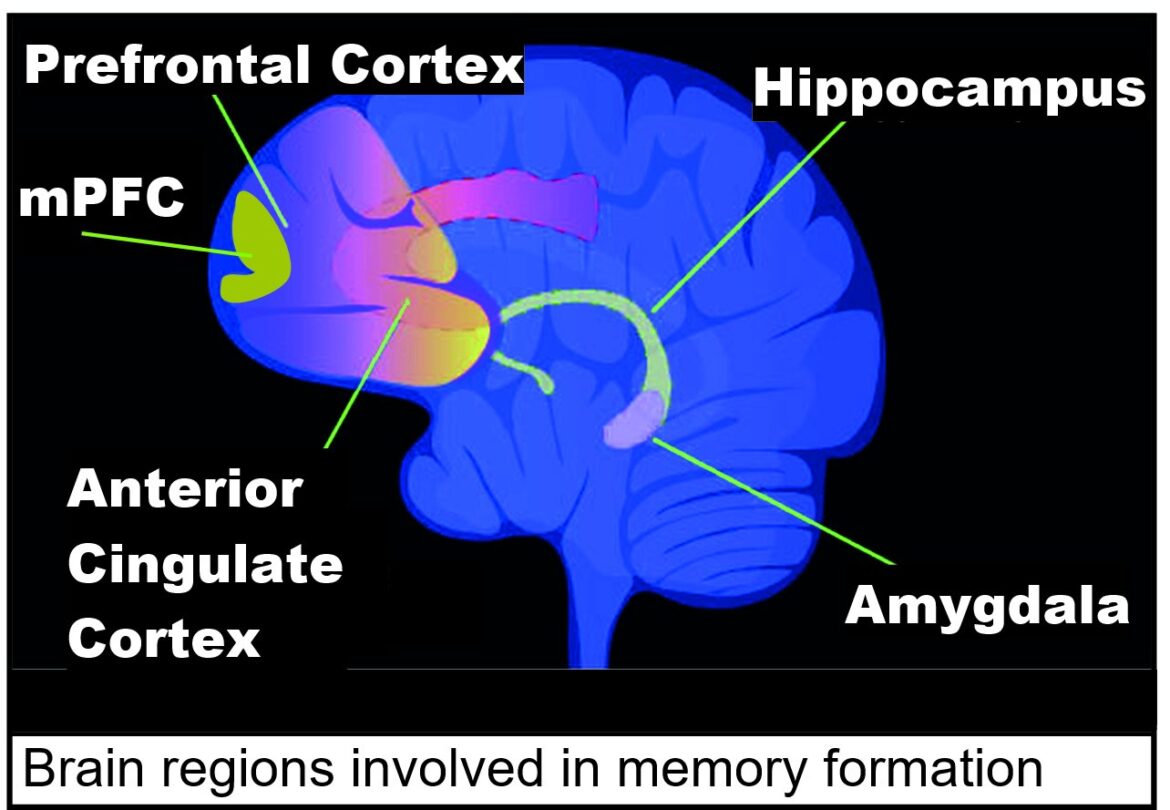
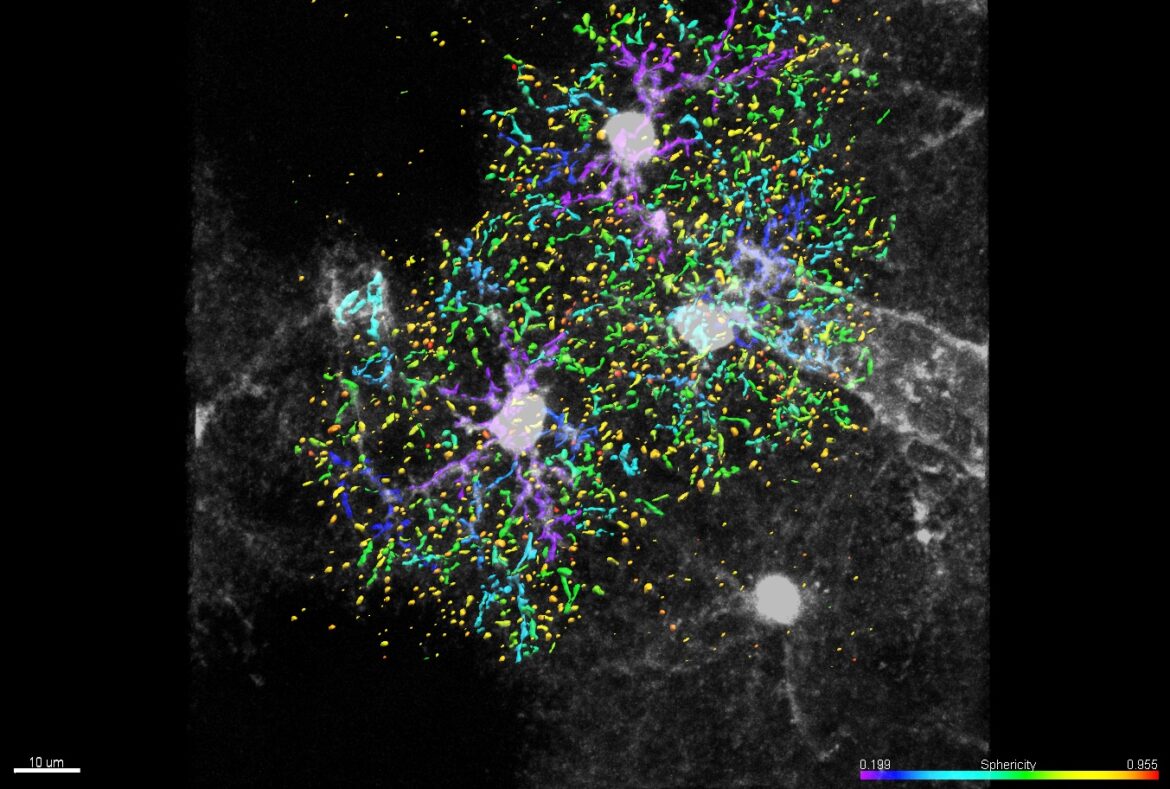
Poter vedere e descrivere distintamente un singolo neurone, districandolo dalla foresta dei miliardi di cellule e connessioni nel nostro cervello, è al momento una grande sfida per gli studiosi di neuroscienze. Individuare anomalie nella forma e nella struttura neurale a scale così ridotte è infatti un passo cruciale per l’identificazione di diverse neuropatie. Dall’Università di Pisa – in collaborazione con l’Istituto di Psichiatria e Neuroscienze di Parigi – arriva SENPAI, un metodo all’avanguardia per poter produrre immagini ad alta risoluzione della morfologia dei neuroni, caratterizzandone i circuiti fino a scale estremamente ridotte. La ricerca è stata pubblicata su Nature Communications.

“I miliardi di neuroni “impacchettati” nel nostro cervello – spiega Nicola Vanello, docente di bioingegneria presso il Dipartimento di Ingegneria d’Informazione e il Centro Piaggio dell’Università di Pisa – costituiscono una vera e propria giungla, tenuta insieme da connessioni molto complesse. Isolare un singolo albero è estremamente difficile. Poter caratterizzare un neurone singolo preso da un tessuto di un essere vivente è sempre stato un obiettivo primario per la comunità scientifica. SENPAI ci consente di segmentare neuroni ex vivo su scala cellulare e subcellulare, di caratterizzare l’arborizzazione neuronale, i diametri dei rami dendritici o la densità delle spine in modo più accurato e fedele rispetto agli attuali algoritmi e strumenti di elaborazione delle immagini.”
“Particolarmente importante è la caratterizzazione delle spine dendritiche – prosegue Simone Cauzzo, post-doc in bioingegneria e primo autore dell’articolo – che sono responsabili degli input elettrici tra le sinapsi. Dalla loro forma, dimensione e numero dipendono funzioni come l’apprendimento, la memoria e la motivazione. Infatti, alterazioni di questi parametri e dunque dell’attività sinaptica sono riscontrabili in molte condizioni patologiche, come l’Alzheimer, e in diverse disfunzioni cerebrali. Poter vedere la forma di queste piccole componenti del neurone può farci compiere enormi passi in avanti nella comprensione del nostro cervello.”
Il metodo è stato sviluppato dal team di bioingegneri dell’Università di Pisa nell’ambito del progetto SENSEI del Centro di Ricerca di Ateneo “E. Piaggio”, finanziato dal MUR per il programma FLAG-ERA, e si fonda su tecniche avanzate di acquisizione delle immagini dei campioni di tessuto cerebrale, successivamente elaborate da un algoritmo, in grado di segmentare i singoli neuroni e ricostruire un modello in 3D.
“Fin dallo scorso secolo, le tecniche di imaging si sono rivelate fondamentali per studiare il sistema nervoso, basta pensare a Camillo Golgi – spiega Chiara Magliaro, ricercatrice in bioingegneria al Dipartimento di Ingegneria dell’Informazione e al Centro Piaggio dell’Università di Pisa – Oggi, le tecniche di imaging si sono affinate: abbiamo microscopi più potenti, e protocolli di preparazione del campione che ci permettono di vedere più in profondità, più in dettaglio. Il valore aggiunto di SENPAI è la piena sinergia con queste tecniche, che ci ha permesso di ricostruire le cellule nervose con un dettaglio senza precedenti”.
L’utilizzo combinato di imaging avanzato e di SENPAI contribuirà al miglioramento delle indagini sul sistema nervoso umano, anche tramite lo studio di costrutti cellulari complessi, quali gli organoidi cerebrali, nell’ottica di ridurre la sperimentazione animale.
Riferimenti bibliografici:
Cauzzo, S., Bruno, E., Boulet, D. et al. A modular framework for multi-scale tissue imaging and neuronal segmentation, Nat Commun 15, 4102 (2024), DOI: https://doi.org/10.1038/s41467-024-48146-y

Testo e immagini dall’Unità Comunicazione Istituzionale dell’Università di Pisa.