Scoperto un nuovo meccanismo di attivazione del nostro sistema immunitario cerebrale
Le ricercatrici e i ricercatori della Sapienza e dell’IIT svelano un meccanismo fondamentale per l’attivazione della microglia, un gruppo di cellule del sistema nervoso ancora poco compreso. Queste scoperte gettano le basi per possibili nuovi trattamenti contro il dolore neuropatico, spesso riscontrato in seguito alla chemioterapia.

Un team di ricercatori e ricercatrici guidato da Silvia Di Angelantonio del Dipartimento di Fisiologia e farmacologia “V. Erspamer” della Sapienza e del laboratorio Nanotechnologies for neurosciences, coordinato da Giancarlo Ruocco dell’Istituto Italiano di Tecnologia (IIT), in collaborazione con la Columbia University, ha pubblicato un articolo sulla rivista Cell Reports dove ha messo in luce un nuovo meccanismo di attivazione della microglia, una tipologia di cellule che costituisce la prima linea di difesa nel cervello. Questa scoperta potrebbe costituire la base di nuovi approcci da impiegare contro il dolore neuropatico, spesso riscontrato in seguito ai trattamenti chemioterapici, in cui la microglia è coinvolta.
La microglia è una tipo di cellula presente nel cervello, dove svolge funzione immunitaria, ossia difende il sistema nervoso da ciò che potrebbe danneggiarlo, come patogeni, cellule tumorali o infiammazione. Quando non sono presenti minacce, le cellule della microglia sono presenti nel cosiddetto “stato non attivato” o “di sorveglianza” caratterizzato da un gran numero di ramificazioni che vengono sfruttate proprio per sorvegliare l’ambiente del cervello alla ricerca di segnali di pericolo che, una volta trovati, faranno acquisire alla microglia il suo “stato attivato” passando da una forma ramificata a una forma tondeggiante, conformazione con il quale può svolgere la sua funzione di difesa.
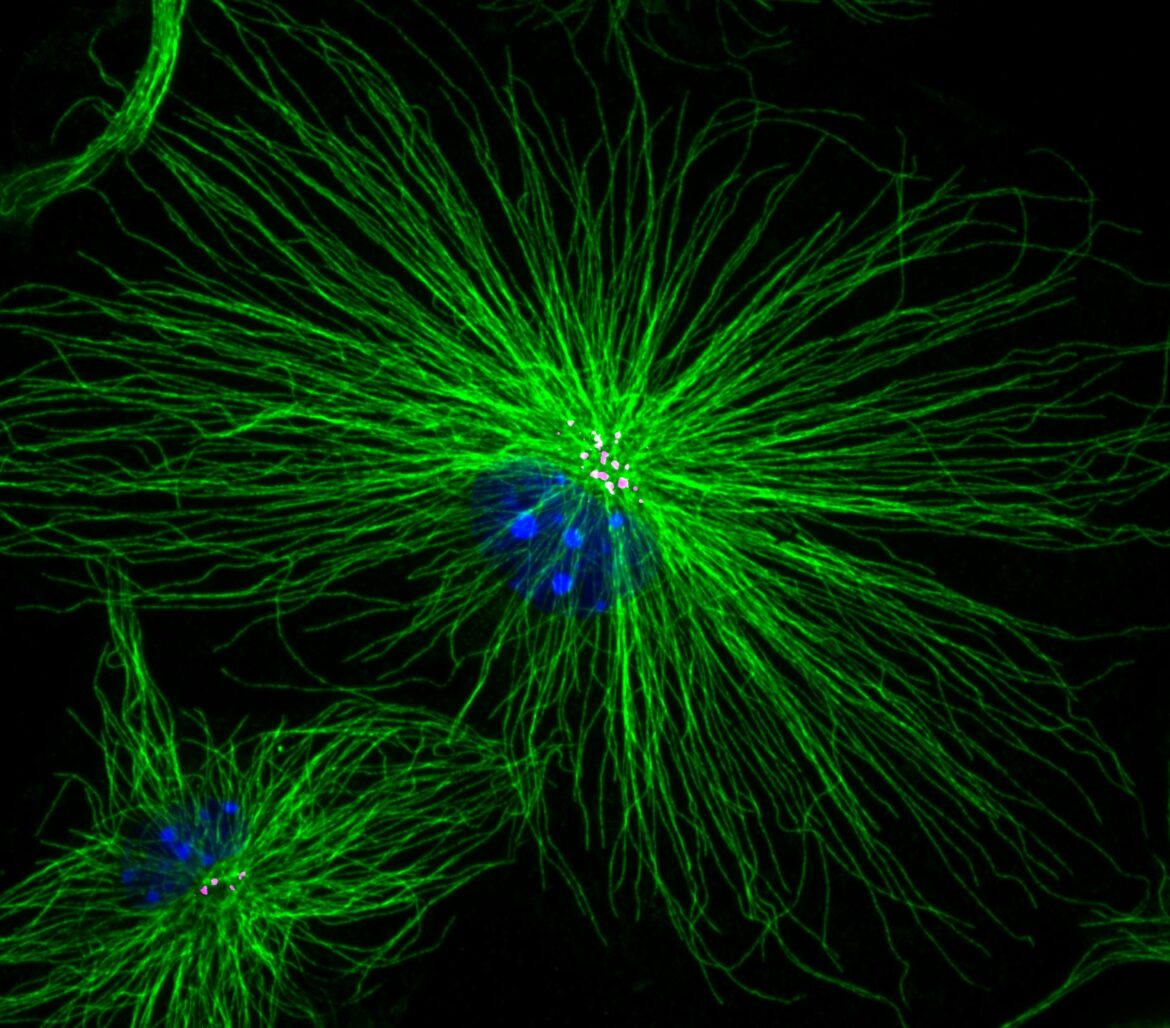
Il gruppo ha scoperto il ruolo fondamentale che hanno i microtubuli, elementi fondamentali per dare la forma alle cellule, in questa conversione da stato non attivato a stato attivato.
Nella microglia non attivata i microtubuli si allineano parallelamente, mentre in quella attivata si dispongono a raggiera, simile a una ruota di bicicletta. Questa riorganizzazione dei microtubuli è fondamentale per l’attivazione della microglia, infatti, bloccando questo processo nel corso dei loro esperimenti, il team ha notato che la microglia non riusciva più ad attivarsi.
Mentre la microglia ramificata non attivata e quella tondeggiante attivata sono entrambe essenziali per la salute del cervello, la microglia che rimane bloccata nello stato attivato contribuisce all’infiammazione cerebrale e alla progressione di malattie neurodegenerative come Parkinson e Alzheimer.
Inoltre, la microglia è implicata nello sviluppo del dolore neuropatico, spesso riscontrato in pazienti trattati con la terapia chemioterapica. Ciò è dovuto al fatto che alcuni farmaci chemioterapici vanno ad attaccare i microtubuli per distruggere le cellule cancerogene. Il problema è che spesso questi farmaci colpiscono non solo le cellule tumorali, ma anche quelle sane, generando quindi il dolore.
“Il futuro sarà lo sviluppo di nuovi approcci terapeutici mirati a modulare in maniera specifica i cambiamenti dei microtubuli della microglia, senza andare a intaccare le altre cellule – conclude Silvia Di Angelantonio, coordinatrice dello studio – Questo nell’ottica di prevenire o contrastare l’attivazione patologica della microglia. Siamo solo all’inizio di questo percorso, ma ci stiamo muovendo in questo senso”.
Riferimenti:
Microglia reactivity entails microtubule remodeling from acentrosomal to centrosomal arrays – Rosito M, Sanchini C, Gosti G, Moreno M, De Panfilis S, Giubettini M, Debellis D, Catalano F, Peruzzi G, Marotta R, Indrieri A, De Leonibus E, De Stefano ME, Ragozzino D, Ruocco G, Di Angelantonio S, Bartolini F. – Cell Reports 2023 Feb 28 42(2): 112104. DOI: https://doi.org/10.1016/j.celrep.2023.112104
Testo e immagine dal Settore Ufficio stampa e comunicazione Sapienza Università di Roma