Identificato il meccanismo che consente alle cellule del tumore al pancreas di sopravvivere e proliferare in assenza di nutrienti
Uno studio internazionale pubblicato sulla rivista Nature Signal Transduction and Targeted Therapy, che ha visto la collaborazione multidisciplinare di diversi centri in Italia fra cui la Sapienza Università di Roma, ha svelato per la prima volta il meccanismo di sopravvivenza e progressione neoplastica di questo tumore, aprendo la strada a nuovi approcci terapeutici.
Da un punto di vista biologico, le cellule tumorali sono continuamente sottoposte a stress: il loro microambiente infatti è povero di ossigeno e soprattutto povero di nutrienti. Questo è particolarmente vero per il tumore del pancreas, una delle neoplasie più temibili dei nostri tempi, spesso resistente ai trattamenti. Come il tumore del pancreas sia in grado di mantenere un alto tasso di proliferazione in carenza di nutrienti è ancora ignoto.
Uno studio internazionale pubblicato sulla rivista Nature Signal Transduction and Targeted Therapy, che ha visto la collaborazione multidisciplinare di diversi centri in Italia fra cui la Sapienza Università di Roma, ha svelato per la prima volta il meccanismo di sopravvivenza e progressione di questo tumore, aprendo la strada a nuovi approcci terapeutici.
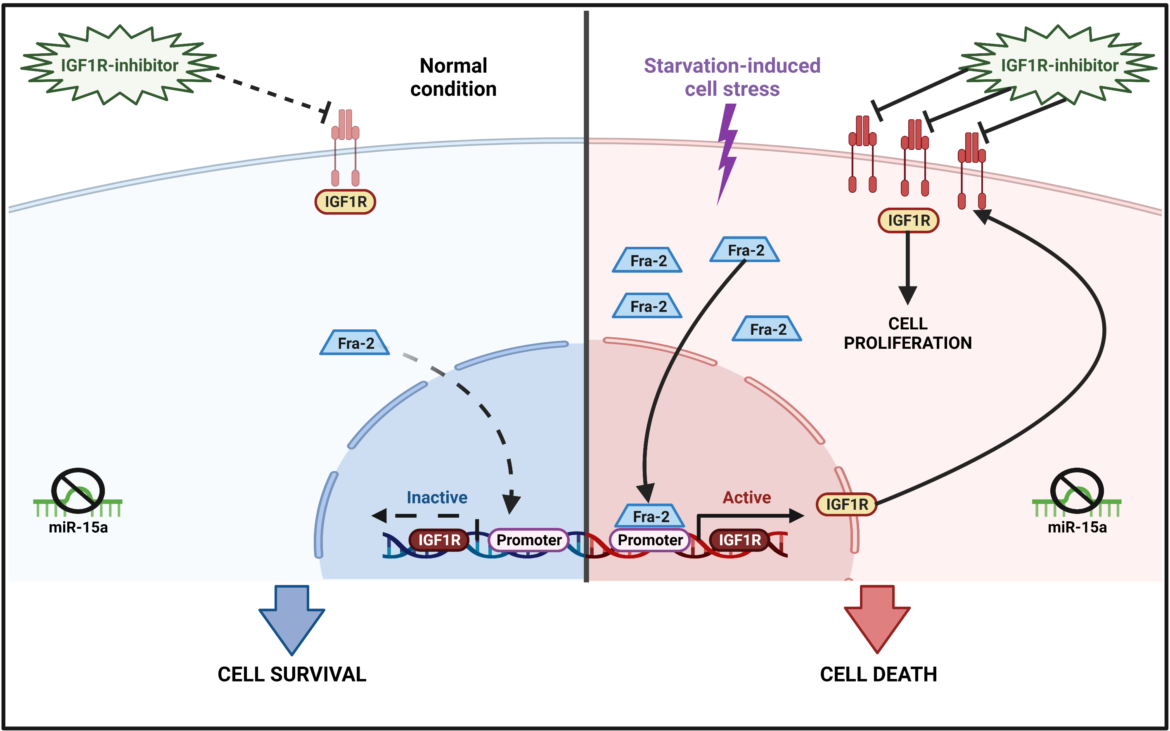
Secondo i ricercatori, alla base vi è la mancata espressione di una piccola molecola di RNA non codificante (microRNA) denominata miR-15a, la quale è normalmente espressa nel pancreas sano ma viene spesso persa durante le fasi precoci di trasformazione neoplastica. Il miR-15a rappresenta una sorta di freno molecolare che mantiene costantemente bassi i livelli della proteina Fra-2, un fattore di trascrizione di cruciale importanza per la risposta del tumore allo stress.
In assenza di miR-15a, le cellule tumorali sollecitate dalla carenza di nutrienti sono libere di esprimere il fattore di trascrizione Fra-2 che, a cascata, attiva la trascrizione di geni fondamentali per la loro sopravvivenza. Tra i geni targets di Fra-2, vi è il recettore per IGF1 (IGF1-recettore), responsabile dello stimolo proliferativo.
“La scoperta di questo meccanismo – spiega Gian Luca Rampioni Vinciguerra, primo nome dello studio e ricercatore del Dipartimento di Medicina Clinica e Molecolare della Sapienza – accresce la nostra comprensione della malattia e fornisce un razionale utile per l’impostazione delle terapie. Nei nostri modelli, il tumore del pancreas in carenza di nutrienti diventa dipendente dall’attivazione di IGF1-recettore e, quindi, estremamente sensibile alla sua inibizione farmacologica, che diventa un’arma estremamente efficace per contrastare la crescita tumorale”.
Il lavoro è stato concepito dal Professor Carlo Maria Croce (The Ohio State University, USA), lo scienziato italiano più citato al mondo secondo top italian scientists, che nella sua lunga carriera ha compiuto scoperte fondamentali nel campo della genetica dei tumori. La ricerca si è avvalsa inoltre della collaborazione multidisciplinare di diversi centri in Italia, quali l’Università Sapienza di Roma, l’Università di Modena e Reggio Emilia e il Centro di Riferimento Oncologico di Aviano.

Riferimenti bibliografici:
Nutrient restriction-activated Fra-2 promotes tumor progression via IGF1R in miR-15a downmodulated pancreatic ductal adenocarcinoma – Gian Luca Rampioni Vinciguerra, Marina Capece, Luca Reggiani Bonetti, Giovanni Nigita, Federica Calore, Sydney Rentsch, Paolo Magistri, Roberto Ballarin, Fabrizio Di Benedetto, Rosario Distefano, Roberto Cirombella, Andrea Vecchione, Barbara Belletti, Gustavo Baldassarre, Francesca Lovat & Carlo M. Croce – Signal Transduction and Targeted Therapy 2024, DOI: https://doi.org/10.1038/s41392-024-01740-4
Testo e immagine dal Settore Ufficio stampa e comunicazione Sapienza Università di Roma