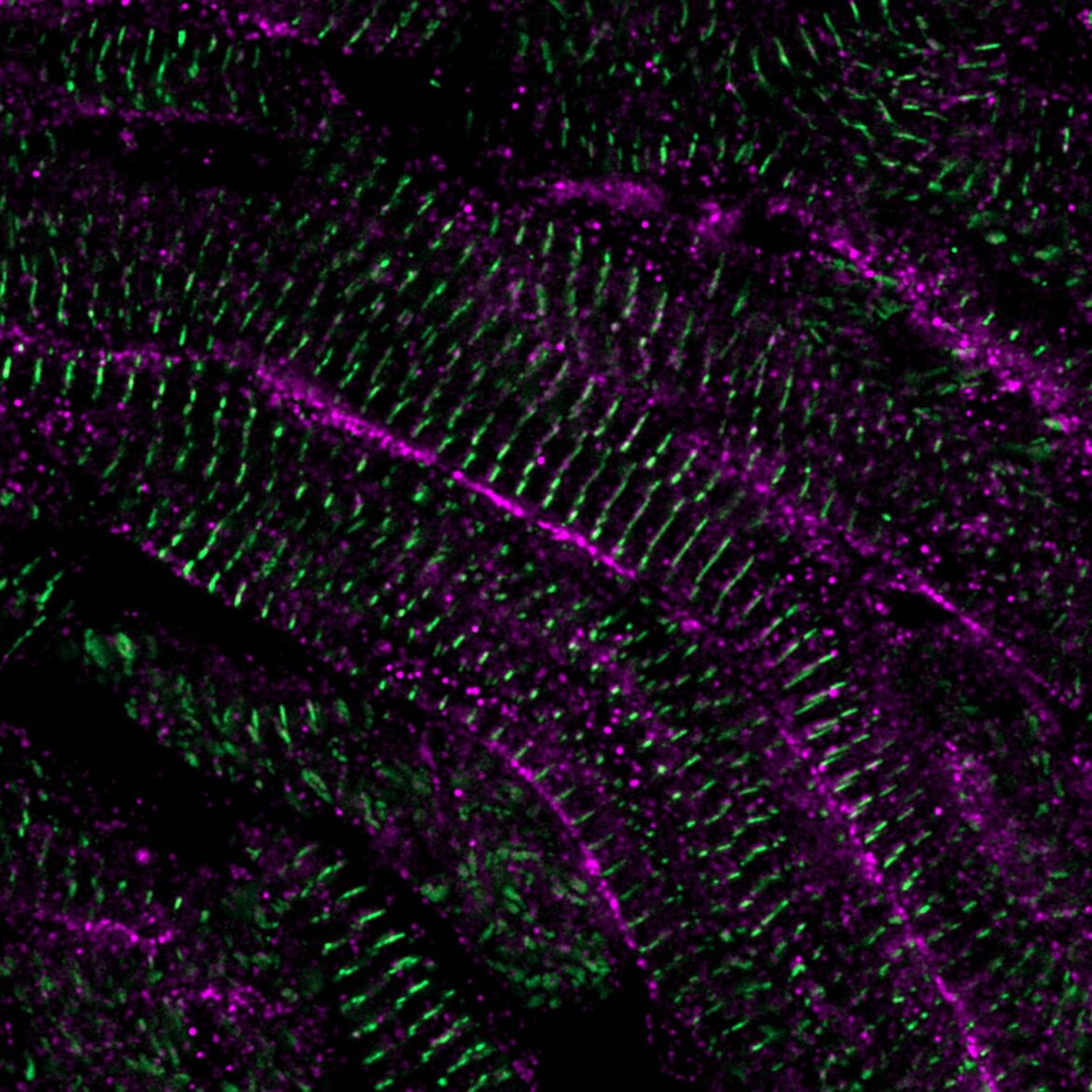
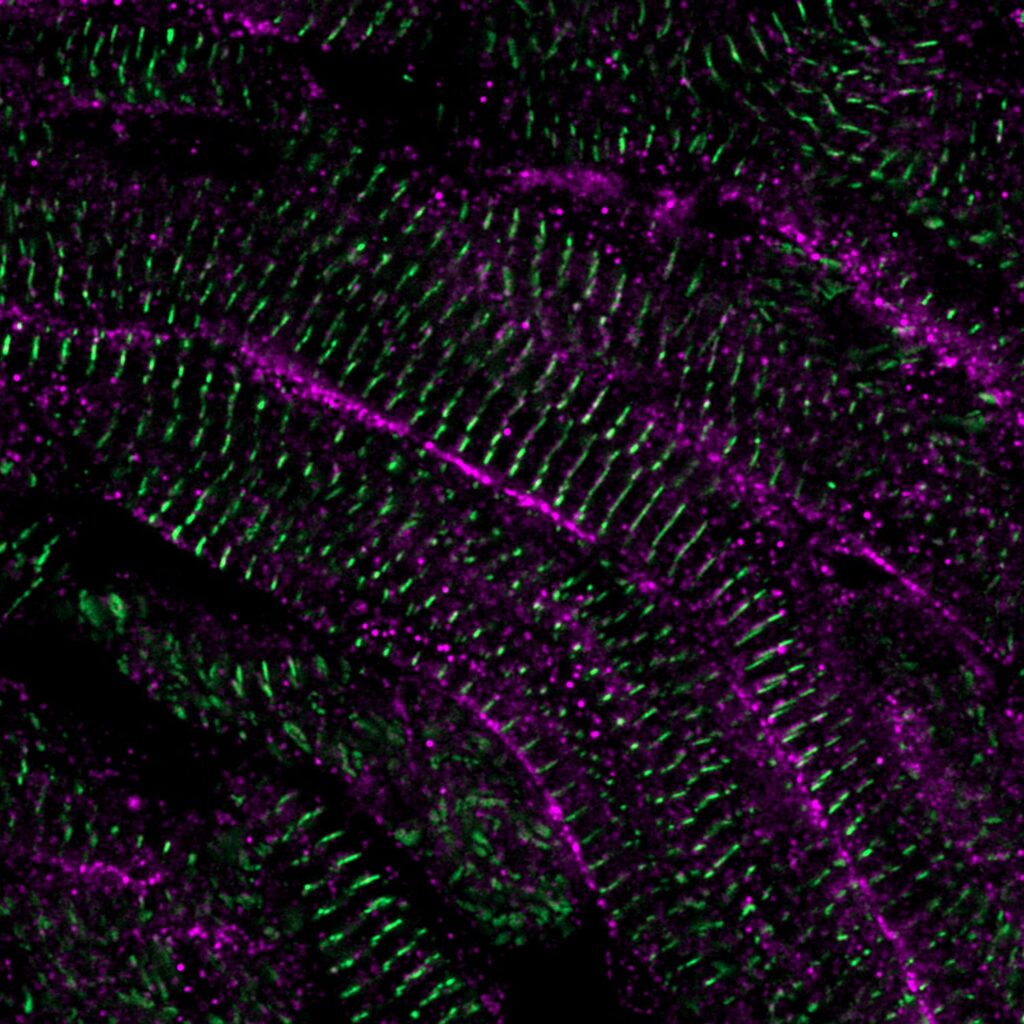
I MECCANISMI DI RIGENERAZIONE DELLE CELLULE DANNEGGIATE NEL CUORE, DAL PESCE ZEBRA ALL’UOMO?
Scoperti i meccanismi che rigenerano le cellule del cuore nel pesce zebra. Il ruolo di LRRC10 nel decidere se la cellula del muscolo cardiaco si dividerà o proseguirà verso la maturazione.
Lo studio, pubblicato su «Science» dai ricercatori dell’Hubrecht Institute, ha visto la collaborazione del gruppo padovano di Milena Bellin.
Le malattie cardiovascolari, quali l’infarto, sono fra le principali cause di morte a livello globale a causa della limitata capacità rigenerativa del cuore. Diversamente dall’uomo, il pesce zebra (zebrafish) ha la straordinaria capacità di guarire da danni a livello cardiaco. I ricercatori del gruppo di Jeroen Bakkers (Hubrecht Institute) hanno impiegato zebrafish per fare luce sulla capacità rigenerativa di questo organismo scoprendo un nuovo meccanismo che agisce da interruttore per spingere le cellule del muscolo cardiaco alla maturazione durante il processo di rigenerazione. Questo meccanismo si è conservato a livello evolutivo, avendo effetti molto simili sulle cellule muscolari cardiache del topo e dell’uomo. Applicare queste scoperte alle cellule del muscolo cardiaco umano potrebbe contribuire allo sviluppo di nuove terapie per contrastare le malattie cardiovascolari.
Si stima che ogni anno 18 milioni di persone muoiano a causa di malattie cardiovascolari nel mondo. Molti di questi decessi sono associati a infarto. Quando ciò avviene, coaguli del sangue bloccano l’apporto di nutrienti e ossigeno a regioni del cuore. Di conseguenza, le cellule muscolari cardiache presenti nella porzione di cuore ostruita muoiono, portando a insufficienza cardiaca. Benché esistano terapie capaci di gestire tali sintomi, non esistono trattamenti capaci di rimpiazzare il tessuto perso con cellule del muscolo cardiaco mature e funzionali, in modo così da curare il paziente.
Diversamente dall’uomo, lo zebrafish ha la capacità di rigenerare il cuore: entro 90 giorni dal danno possono recuperare completamente la funzionalità del cuore. Le cellule muscolari cardiache che sopravvivono al danno si dividono e producono altre cellule. Questa caratteristica unica fornisce al cuore di zebrafish una fonte di nuovo tessuto per rimpiazzare le cellule muscolari cardiache andate perse. Studi precedenti hanno già identificato fattori che potrebbero stimolare la divisione delle cellule del muscolo cardiaco, mai però si è indagato su cosa succede alle cellule muscolari cardiache appena generate.
«Non è chiaro – dice Phong Nguyen dell’Hubrecht Institute e primo autore dello studio – come queste cellule smettano di dividersi e maturino abbastanza da poter contribuire al normale funzionamento del cuore. Ci ha stupito il fatto che nel cuore di zebrafish, il tessuto neoformato maturi naturalmente e si integri al tessuto cardiaco preesistente senza alcun problema».
La regolazione del trasporto del calcio, dentro e fuori le cellule muscolari cardiache, è importante per il controllo della contrazione cardiaca e permette di predire la maturità delle cellule. Per questa ragione i ricercatori hanno sviluppato una tecnica che ha permesso la coltura di grossi lembi di cuore danneggiato di zebrafish al di fuori dell’organismo. Si è così potuto osservare, in tempo reale, come il movimento del calcio all’interno delle cellule del muscolo cardiaco e dopo la divisione delle cellule cambi nel tempo.
«Il trasporto del calcio nelle cellule di nuova divisione all’inizio è apparso molto simile a quello delle cellule muscolari cardiache embrionali, ma nel tempo queste cellule hanno assunto un trasporto del calcio di tipo maturo – continua Nguyen –. Abbiamo scoperto che la “diade” cardiaca, una struttura che facilita il movimento del calcio all’interno delle cellule muscolari cardiache, e nello specifico uno dei suoi componenti, LRRC10, ha un ruolo cruciale nel decidere se la cellula del muscolo cardiaco si dividerà o proseguirà verso la maturazione. Cellule muscolari cardiache che mancano di LRRC10 continuano a dividersi e rimangono immature».
Stabilita l’importanza di LRRC10 nell’arrestare la divisione e avviare la maturazione nelle cellule muscolari cardiache di zebrafish, i ricercatori hanno vagliato se le caratteristiche del pesce potessero essere trasferite nei mammiferi con l’induzione dell’espressione di LRRC10 in cellule del cuore di topo e uomo.
In collaborazione con il gruppo di Milena Bellin – Dipartimento di Biologia, Istituto Veneto di Medicina Molecolare e Leiden University Medical Center – si sono studiati i cardiomiociti umani generati da cellule staminali pluripontenti umane coltivate in laboratorio: le osservazioni sperimentali hanno provato che LRRC10 è importante anche nella maturazione di cellule cardiache umane. Gli esperimenti sono stati condotti al Leiden University Medical Center da Giulia Campostrini, ricercatrice guidata da Milena Bellin e Christine Mummery.
«Questo lavoro si è basato su nostri precedenti studi sulla maturazione dei cardiomiociti: è stato emozionante vedere che il ruolo di LRRC10 sia conservato fra uomo e zebrafish. Sorprendentemente – osserva Milena Bellin – la presenza di LRRC10 ha cambiato le dinamiche del calcio, ha ridotto la divisione cellulare e aumentato il grado di maturazione di queste cellule in modo simile a quanto osservato nel cuore di zebrafish».
«È stato emozionante – chiosa Nguyen – vedere che ciò che abbiamo imparato da zebrafish può essere trasferito all’uomo e ciò apre nuove possibilità per l’uso di LRRC10 nel contesto di nuove terapie per i pazienti».
I risultati dello studio pubblicato mostrano che LRRC10 ha la capacità di guidare la maturazione delle cellule muscolari cardiache attraverso il controllo della loro gestione del calcio. Ciò potrebbe aiutare gli scienziati che tentano di risolvere la mancanza di capacità rigenerativa del cuore di mammifero attraverso il trapianto, all’interno di cuori danneggiati, di cellule muscolari cardiache coltivate in laboratorio. Benché tale potenziale terapia risulti promettente, i risultati hanno mostrato che queste cellule coltivate in laboratorio sono ancora immature e non sono capaci di comunicare adeguatamente con il resto del cuore, portando così a contrazioni anormali chiamate aritmie.
«Anche se servono studi più approfonditi per definire con precisione che grado di maturazione possano assumere queste cellule muscolari cardiache coltivate in laboratorio quando trattate con LRRC10, è possibile che l’aumento nel grado di maturazione vada a migliorare l’integrazione in seguito a trapianto – sottolinea Jeroen Bakkers dell’Hubrecht Institute e ultimo autore dello studio –. I modelli attuali di malattie cardiovascolari sono spesso basati su cellule muscolari cardiache coltivate in laboratorio. Il 90% dei candidati farmaci più promettenti individuati, sempre in laboratorio, non riescono a raggiungere la fase clinica e l’immaturità di queste cellule potrebbe essere uno dei fattori che contribuiscono a questi scarsi tassi di successo. I nostri risultati indicano che LRRC10 potrebbe anche migliorare la predittività di questi modelli».
LRRC10, dunque, potrebbe dare un importante contributo alla generazione di cellule muscolari cardiache coltivate in vitro che rappresentino con maggior precisione le tipiche cellule cardiache adulte, aumentando così le probabilità di sviluppare nuovi trattamenti efficaci con successo contro le malattie cardiovascolari.
Link alla ricerca: http://www.science.org/doi/10.1126/science.abo6718
Titolo: “Interplay between calcium and sarcomeres directs cardiomyocyte maturation during regeneration” – «Science» 2023
Autori: Phong D. Nguyen, Iris Gooijers, Giulia Campostrini, Arie O. Verkerk, Hessel Honkoop, Mara Bouwman, Dennis E. M. de Bakker, Tim Koopmans, Aryan Vink, Gerda E. M. Lamers, Avraham Shakked, Jonas Mars, Aat A. Mulder, Sonja Chocron, Kerstin Bartscherer, Eldad Tzahor, Christine L. Mummery, Teun P. de Boer, Milena Bellin, Jeroen Bakkers
Lo studio è il risultato di una collaborazione tra l’Hubrecht Institute, Leiden University Medical Center, Amsterdam Medical Center, Utrecht Medical Center e il Weizmann Institute. Lo studio è stato finanziato da Dutch Heart Foundation, Dutch CardioVascular Alliance and Stichting Hartekind, ReNEW, e the European Research Council (CoG Mini-HEART).
Testo, video e immagini dall’Ufficio Stampa dell’Università di Padova sulla rigenerazione delle cellule del cuore nel pesce zebra.