Identificata la causa della malattia genetica rara della piccola Bea nel gene ARHGAP36
La prestigiosa rivista Nature Communications ha pubblicato il lavoro internazionale che ha studiato la malattia rara relativa al caso della piccola Bea.
Nel 2010 Bea venne visitata nell’Ambulatorio di Genetica Clinica Pediatrica dell’Ospedale Infantile Regina Margherita di Torino perché presenta delle tumefazioni alle articolazioni. Le radiografie e la TAC rilevarono rapidamente una situazione molto particolare, una serie di “calcificazioni” che stavano progressivamente trasformando la cartilagine in osso. Bea era una bimba vivace ed intelligente, ma ben presto le articolazioni si bloccarono, rendendo impossibili i movimenti di braccia e gambe. Gli esami radiologici mostrarono un quadro sempre più grave: nessuno specialista aveva mai visto un caso come quello di Bea in tutto il mondo. La famiglia creò una Onlus, si adoperò per far conoscere il caso e la zia pubblicò #Leggera come una piuma – Il Mondo di Bea (Pathos edizioni) per far conoscere la malattia. I mezzi di comunicazione si interessarono al caso e Bea venne conosciuta da molte persone che accompagnarono la famiglia nel lungo percorso di malattia della bambina.
Dopo 13 anni e centinaia di esperimenti, un gruppo internazionale di ricercatori, coordinati dalla dott.ssa Elisa Giorgio ricercatrice dell’Università di Pavia e di Fondazione Mondino IRCCS, è riuscito ad identificare la causa della malattia di Bea, chiarendo come questa sia una malattia genetica non solo rarissima, ma semplicemente unica. La ricerca è iniziata attraverso la collaborazione tra i Pediatri che hanno inizialmente approfondito il quadro clinico (Prof. Giovanni Battista Ferrero, Prof.ssa Margherita Silengo, Università di Torino) ed il laboratorio di Genetica Medica e malattie rare del prof. Alfredo Brusco (Dipartimento di Scienze Mediche; Università di Torino; Città della Salute e della Scienza, Torino). Per capire il complesso meccanismo alla base della malattia è stata necessaria una collaborazione con diversi centri italiani (Dott. Marco Tartaglia, Ospedale Pediatrico Bambin Gesù, Roma; Prof. Massimo Delledonne, Università di Verona) ed esteri (Prof. Malte Spielmann, Università di Lubecca e Kiel, Germania).

Inizialmente erano state approfondite le cause note di malattie genetiche associate alle calcificazioni ectopiche, quadri clinici caratterizzati da formazione di osso in tessuti normalmente non ossificati, come muscoli, tendini e legamenti. Questi disturbi sono solitamente causati da una mutazione genetica, come nella Fibrodisplasia ossificante progressiva (FOP), una rara malattia genetica in cui i muscoli e i tessuti molli vengono gradualmente sostituiti dalle ossa. La FOP è causata da una mutazione nel gene ACVR1, responsabile dell’informazione necessaria per formare tessuto osseo nei vari distretti scheletrici. Quando questo gene è mutato, invia un segnale anomalo a vari tessuti che progressivamente calcificano e si trasformano in osso
LA RICERCA
La malattia di Bea aveva molte similitudini con la FOP, ma si era presentata nelle prime settimane di vita con un’evoluzione molto rapida ed invalidante. Le analisi genetiche avevano da subito escluso questa malattia.
Nel frattempo il gruppo di ricerca aveva identificato, con una serie di approfondimenti, un’anomalia cromosomica unica, mai descritta in letteratura caratterizzata dalla presenza di un segmento del cromosoma 2 doppio, inserito sul cromosoma X della bambina.
Questa anomalia dei cromosomi, ovvero l’inserzione di una regione di un cromosoma su un altro, può portare a un’espressione genica alterata. Questi eventi sono rari, molto eterogenei tra loro, ed è assai complesso capirne le conseguenze biologiche. Solo negli ultimi anni la tecnologia ha messo a disposizione dei ricercatori degli approcci estremamente complessi per poter studiare queste anomalie cromosomiche.
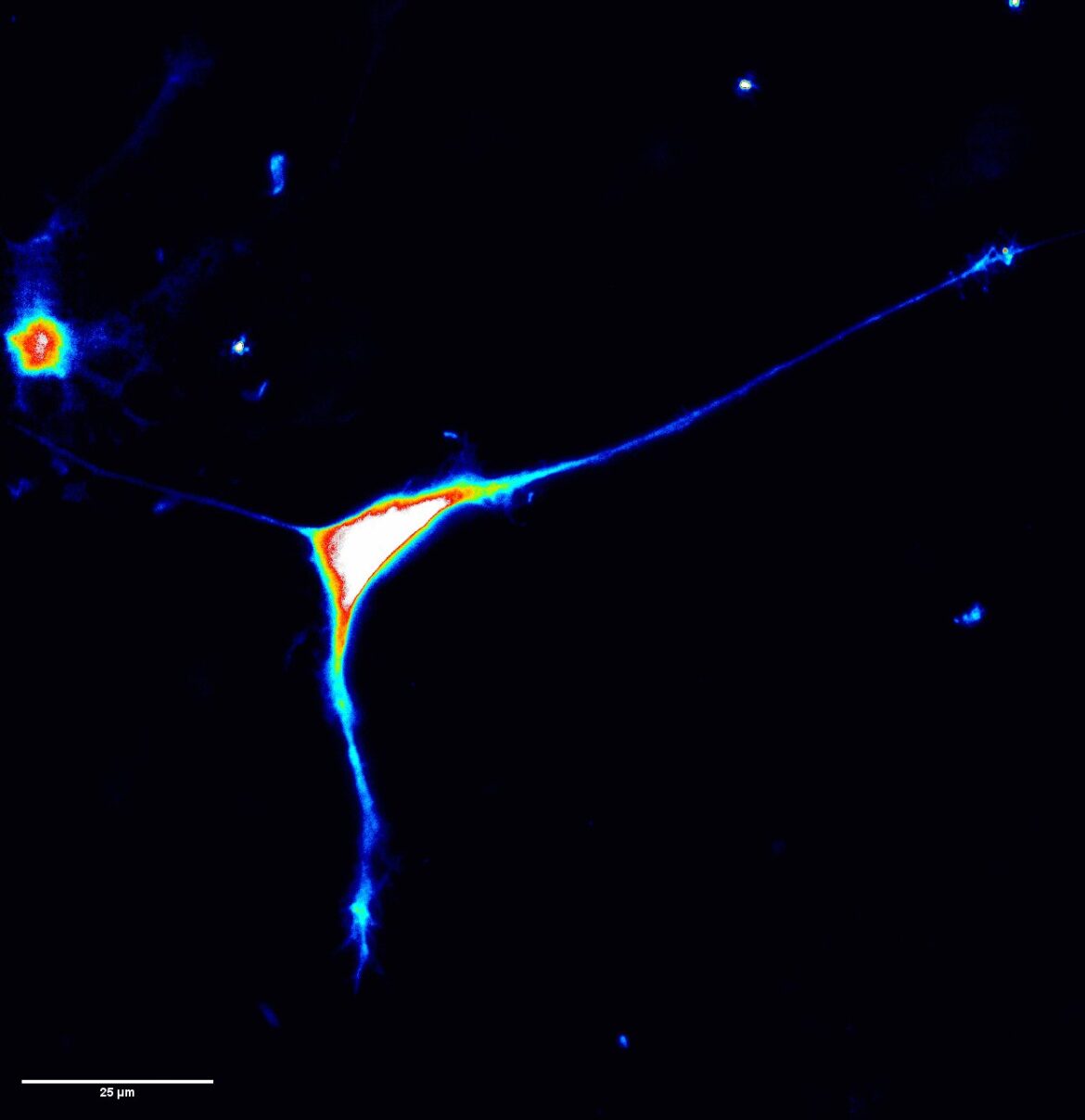
L’attività di ricerca ha permesso di capire che il pezzo di cromosoma 2 in più conteneva delle regioni in grado di attivare i geni sul cromosoma X nei tessuti sbagliati. In particolare, si è dimostrato che il gene ARHGAP36 produce una proteina in quantità molto più elevate dell’atteso, ma soprattutto nel tessuto sbagliato, la cartilagine. Proprio questo gene induce la formazione si tessuto osseo dove non dovrebbe essere presente.
“Questo studio è la dimostrazione di come la collaborazione tra gruppi di ricerca con competenze diverse sia la chiave per ottenere successi scientifici” spiega la dott.ssa Giorgio. “La ricerca ha bisogno di tempo e si costruisce sulle conoscenze che a mano a mano gli scienziati accumulano; nel 2010 non avevamo i mezzi tecnologici, né le conoscenze di base per capire la malattia di Bea”. Proprio la Dott.ssa Giorgio nel 2015 aveva scoperto un meccanismo simile a quello che causa la malattia di Bea (chiamato in gergo tecnico “adozione di un enhancer”) come causa di una rara forma di malattia neurodegenerativa, l’ADLD, adesso uno dei filoni di ricerca del suo laboratorio a Pavia.
La definizione del meccanismo biologico alla base del quadro clinico ha permesso di dare alla famiglia della bambina una risposta attesa da molti anni, una risposta che permette, come in tutte le malattie rare, di porre fine all’odissea diagnostica, complessa e dolorosa che caratterizza queste patologie.
LE PROSPETTIVE
Studiando le malattie rare come quella di Bea, gli scienziati possono trovare percorsi e meccanismi che potrebbero essere coinvolti anche in malattie più comuni. Lo studio identifica un gene ARHGAP36 come implicato nella formazione ossea, un’informazione del tutto sconosciuta fino ad ora. Studiando questo gene e la sua funzione è possibile che capiremo meglio le malattie ossee nella popolazione generale. Al momento è troppo presto per pensare ad un utilizzo pratico della ricerca fatta, ma i ricercatori coinvolti sono entusiasti di aver contribuito a risolvere uno dei casi più difficili di malattia genetica rara conosciuta, quello della piccola Bea.
Nature Communications, Nat Commun. 2023 Apr 11;14(1):2034. doi: 10.1038/s41467-023-37585-8. PMID: 37041138
Enhancer hijacking at the ARHGAP36 locus is associated with connective tissue to bone transformation.
Melo US, Jatzlau J, Prada-Medina CA, Flex E, Hartmann S, Ali S, Schöpflin R , Bernardini L, Ciolfi A, Moeinzadeh M-H, Klever M-K, Altay A, Vallecillo-Garcia P, Carpentieri G, Delledonne M, Ort M-J, Schwestka M, Ferrero GB, Tartaglia M, Brusco A, Gossen M, Strunk D, Geißler S, Mundlos S, Stricker S, Knaus P, Giorgio E, Spielmann M. – https://www.nature.com/articles/s41467-023-37585-8
Testo dall’Ufficio Stampa Area Relazioni Esterne e con i Media Università degli Studi di Torino