RUOLO CENTRALE PER LA GLUTAMMINA NELLA RIGENERAZIONE DEL MUSCOLO E NELL’INIBIZIONE DELLE METASTASI TUMORALI
Due recenti ricerche internazionali guidate dal Prof. Massimiliano Mazzone, docente straordinario al Dipartimento di Biotecnologie Molecolari e Scienze per la Salute di UniTo e afferente al VIB-KU Leuven Center for Cancer Biology, rivelano l’importanza della glutammina nella risposta infiammatoria in seguito a tumore o a danno degenerativo tissutale.
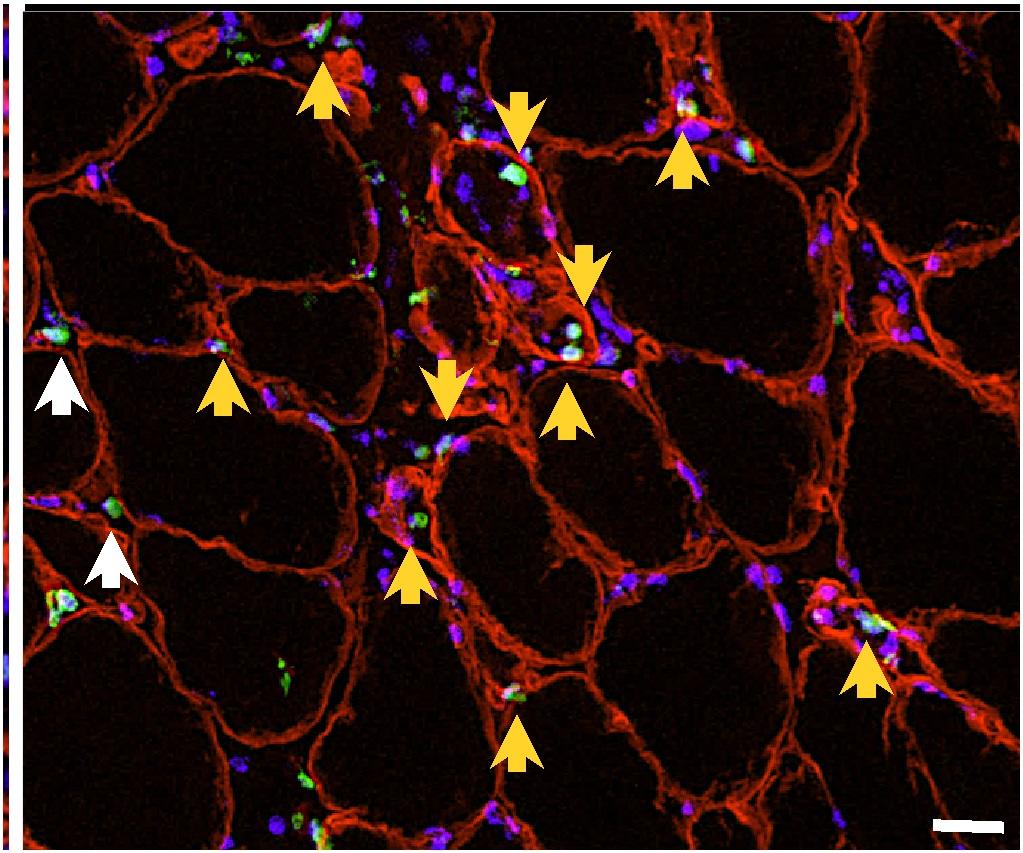
Sono due i lavori pubblicati su prestigiose riviste scientifiche internazionali, Nature il 28 ottobre e EMBO Molecular Medicine il 28 agosto, guidati dal Prof. Mazzone che con il suo team di ricerca ha dimostrato come il metabolismo della glutammina con la sua capacità di influire sulla rigenerazione delle fibre muscolari e sull’inibizione delle metastasi tumorali apre nuove prospettive per la cura dell’invecchiamento muscolare
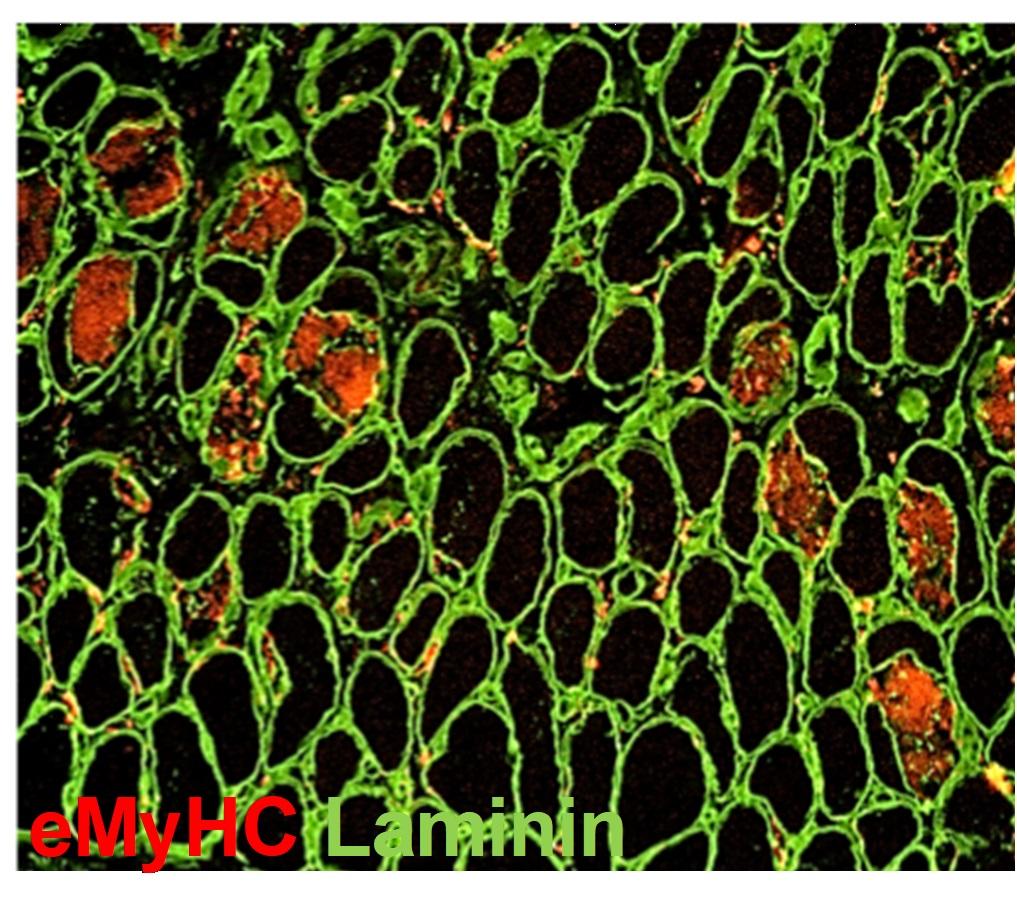
In particolare Mazzone e il suo team, nel lavoro pubblicato su Nature (“Macrophage-derived glutamine boosts satellite cells and muscle regeneration”), dimostrano un dialogo metabolico tra un tipo di cellule infiammatorie, chiamate macrofagi, e cellule staminali muscolari, chiamate satelliti, che, se potenziato con un inibitore dell’enzima GLUD1, favorisce il rilascio di glutammina. In questo modo l’aminoacido migliora la rigenerazione muscolare stimolando la proliferazione e il differenziamento delle cellule staminali, e quindi aumentando le prestazioni fisiche in modelli sperimentali di degenerazione muscolare come traumi, ischemia ed invecchiamento.
I ricercatori hanno osservato che, in seguito a danni muscolari degenerativi, tra i quali l’invecchiamento, i normali livelli di glutammina nel muscolo diminuiscono in conseguenza della morte del tessuto muscolare. La ri-stabilizzazione dei livelli originali di glutammina stimola la rigenerazione delle fibre muscolari.
La glutammina assume quindi il ruolo di molecola sensore, garante dell’integrità tissutale, per cui i suoi livelli all’interno del tessuto muscolare controllano un programma rigenerativo. Inoltre, lo studio suggerisce l’enzima GLUD1 come bersaglio terapeutico per promuovere la rigenerazione muscolare dopo lesioni acute come traumi o ischemie, oppure in condizioni degenerative croniche come appunto l’invecchiamento.
Lo studio, oltre al suo potenziale traslazionale, fornisce spunti chiave in diversi ambiti medico-scientifici tra cui il metabolismo del sistema immunitario, la biologia delle cellule staminali, e la fisiologia del muscolo.
Gli studi sulla glutammina hanno portato Mazzone e i suoi a fornire un importante contributo anche per la ricerca sul cancro. Il lavoro pubblicato sulla rivista EMBO Molecular Medicine (“Glufosinate constrains synchronous and metachronous metastasis by promoting anti‐tumor macrophages) analizza la glutammina sintetasi (GS), cioè l’enzima che genera glutammina dal glutammato, come il crocevia che controlla il rilascio di mediatori infiammatori. L’inibizione farmacologica della GS nei macrofagi blocca le metastasi aumentando l’immunità anti-tumorali.
Su questa base è stato valutato il potenziale farmacologico di derivati del glufosinato, comunemente usato come erbicida, nel ruolo di inibitori specifici della glutammina sintetasi nella lotta alle metastasi. I ricercatori hanno scoperto che il glufosinato ricabla i macrofagi sia nel tumore primario che nella sede metastatica, contrastando l’immunosoppressione e la formazione di nuovi vasi tumorali. Questo effetto è stato osservato in modelli sperimentali murini in condizioni di malattia primaria e metastatica o dopo rimozione del tumore primaria nel trattamento di ricaduta metastatica. Il trattamento con glufosinato è stato ben tollerato, senza tossicità epatica o cerebrale, né difetti ematopoietici.
Questi risultati, in conclusione, identificano il bersagliamento farmacologico della glutammina sintetasi come prospettiva utile per ricablare le funzioni dei macrofagi. Un potenziale straordinario per il trattamento delle metastasi tumorali.
“Questi due studi offrono conoscenza biologica sia nel campo della rigenerazione tissutale che della progressione tumorale” spiega il Prof. Mazzone “ma identificano già in questa fase due molecole sulle quali lavorare per creare nuovi farmaci. Le ricerche sono il frutto di un lavoro intenso condotto in Italia, tra le Università di Torino, ed in particolare il Centro per le Biotecnologie Molocolari (MBC) e l’Università di Bari, e in Belgio, all’Università di Lovanio e al VIB. Questo lavoro non si sarebbe potuto realizzare senza il contributo essenziale del Dottor Berardi, la Dottoressa Min Shang, il Dottor Menga, ricercatori in Belgio e a Torino, e la Professoressa Castegna, docente presso l’Università di Bari”.
La Professoressa Fiorella Altruda, direttrice del Centro per le Biotecnologie Molecolari aggiunge con orgoglio: “Siamo contenti di avere riportato un anno e mezzo fa il Professor Mazzone alla sede che lo ha formato 15 anni fa. In poco tempo dalla sua nomina a Professore Ordinario Straordinario, Massimiliano si è ben collocato all’interno del Centro, sviluppando nuove linee di ricerca ed iniziando moltissime collaborazioni con altri gruppi di ricerca nel Centro ma anche a livello nazionale ed internazionale”.

Il Professor Mazzone si è laureato con il massimo dei voti in Bioteconologie Mediche nel 2002 e ha conseguito il Dottorato di Ricerca nel Febbraio del 2007 presso Istituto per la Ricerca e la Cura del Cancro, sempre all’Università di Torino. Trasferitosi per i suoi studi specialistici all’Università di Lovanio nell’Ottobre del 2006, dal 2009 Mazzone dirige il Laboratorio di Infiammazione ed Angiogenesi presso l’Istituto fiammingo per le Biotecnologie VIB e dal 2016 è Professore Ordinario presso l’Università Cattolica di Lovanio. Dal 2019 Mazzone è Professore Straordinario all’Università di Torino dove dirige un secondo gruppo di ricerca presso il Centro per le Biotecnologie Molecolari. Mazzone è autore di 126 lavori in riviste mediche prestigiose che hanno già ricevute, in totale, oltre 10000 citazioni. Il Professore ad oggi è stato invitato più di 150 volte a dare interventi scientifici in tutto il mondo, presiede ad importanti commissioni di valutazione della ricerca accademica ed industriale, ed ha organizzato lui stesso diverse conferenze di importanza mondiale. Ha ricevuto più di 15 premi di prestigio nazionale ed internazionale, tra cui 3 consecutivi riconoscimenti dal Consiglio Europeo della Ricerca. Il Professor Mazzone ha contribuito all’insegnamento in diversi corsi di laurea e di Dottorato, e fino ad oggi ha contribuito alla crescita scientifica di 50 tesisti in Medicina, Farmacia, Biologia e Biotecnologie, 16 ricercatori afferenti a diversi Dottorati di Ricerca, e 14 ricercatori post-Dottorato, tutti insieme provenienti da 20 diverse nazioni. Nel 2017 ha co-fondato una prima industria farmaceutica (Oncurious) e due anni dopo, una seconda industria chiamata Montis Biosciences, e detiene 15 brevetti. Negli ultimi 5 anni, Mazzone ha co-sviluppato due farmaci anti-tumorali che hanno visto la fase sperimentale clinica in collaborazione con due altre aziende farmaceutiche, ed ha maturato l’idea per un kit diagnostico per il cancro al colon. La ricerca del suo team si focalizza da sempre sull’infiammazione in particolare nel tumore ma anche in altre condizioni patologiche come rigenerazione ed infezioni, ponendo la carenza di ossigeno (meglio conosciuta come ipossia) e il metabolismo al centro delle sue scoperte. Recentemente, il focus della sua ricerca si è centralizzato sui meccanismi di resistenza all’immunoterapia dei tumori. Mazzone ha contribuito in maniera fondamentale in questi settori della biologia ed è riconosciuto come un leader mondiale emergente nei campi dell’infiammazione e della regolazione del microambiente tumorale.
Testo e immagini dall’Università degli Studi di Torino





